メタアナリシスの読み方をまとめたページはこちら
実臨床に役立てるメタアナリシスの読み方まとめ – 脳内ライブラリアン
今回はまず前提知識として
①「システマティックレビュー」と「メタアナリシス」の違いは何か
②どのような流れでその2つが組み合わさるのか
の2点について書いていこうと思います。
目次:
システマティックレビューとメタアナリシスとは何か
システマティックレビューとその目的
古典的に医学分野でよく言われる定義として、システマティックレビューは「臨床的疑問に対し、再現可能な方法で系統的に文献を集め、結果を吟味したもの」と言えます。
対象とする臨床的疑問は診断、予後、治療、副作用など多岐にわたります。
もともと個々の研究もこうした臨床的疑問に答えるためのものですが、ひとつの研究だけではどうしても結果が偏ってしまったり、正しい結果が得られていない可能性があります。
そこで、過去の複数の研究を定めた方法に従って収集し、結果を吟味することで、より正しい結果を導こうとするのがシステマティックレビューです。
ここで肝心なのは「定めた方法で、系統的に」文献を集めるという点です。
著者の思いつくままに文献を集めるとすると、著者の思い込みやバイアスのもとに文献が集まってしまい、正しい結果が得られる可能性が低くなります。
特に、著者に何らかの主張があるとするとその主張に沿った文献が目につきやすくなるため反例となるような文献が集められにくくなります(確証バイアス)。
そうではなく、臨床的疑問に沿った質の良いデータが得られるように事前に方法を決め、それに沿って文献を集めることで、バイアスを避けることができ、また再現性も得ることができます。
ちなみに、ナラティブレビューと呼ばれる方法では、著者が恣意的に文献を集めるため、偏った結果が導き出される可能性が高くなります。ただ、これはこれで、その分野においてどんな文献があって、専門家(著者)の間ではどういった点が重要視されているのかをざっと掴みやすいため重宝します。
メタアナリシスとその目的
古典的な定義において、メタアナリシスは「得られた結果を統合すること」を指します。吟味された論文の結果を統合し、初めの臨床的疑問に対しての答えを出します。
結果が数値として明確に示されると臨床的な応用につなげやすくなり、より有用性が増すと言えます。
なお、今回の記事ではシステマティックレビューとメタアナリシスの違いをよく認識することが重要なので、分けて書きますが、実際のところ両者を合わせて「メタアナリシス」と呼ばれることも多いため、次回の記事ではそのように記載します。
システマティックレビューからメタアナリシスの流れ
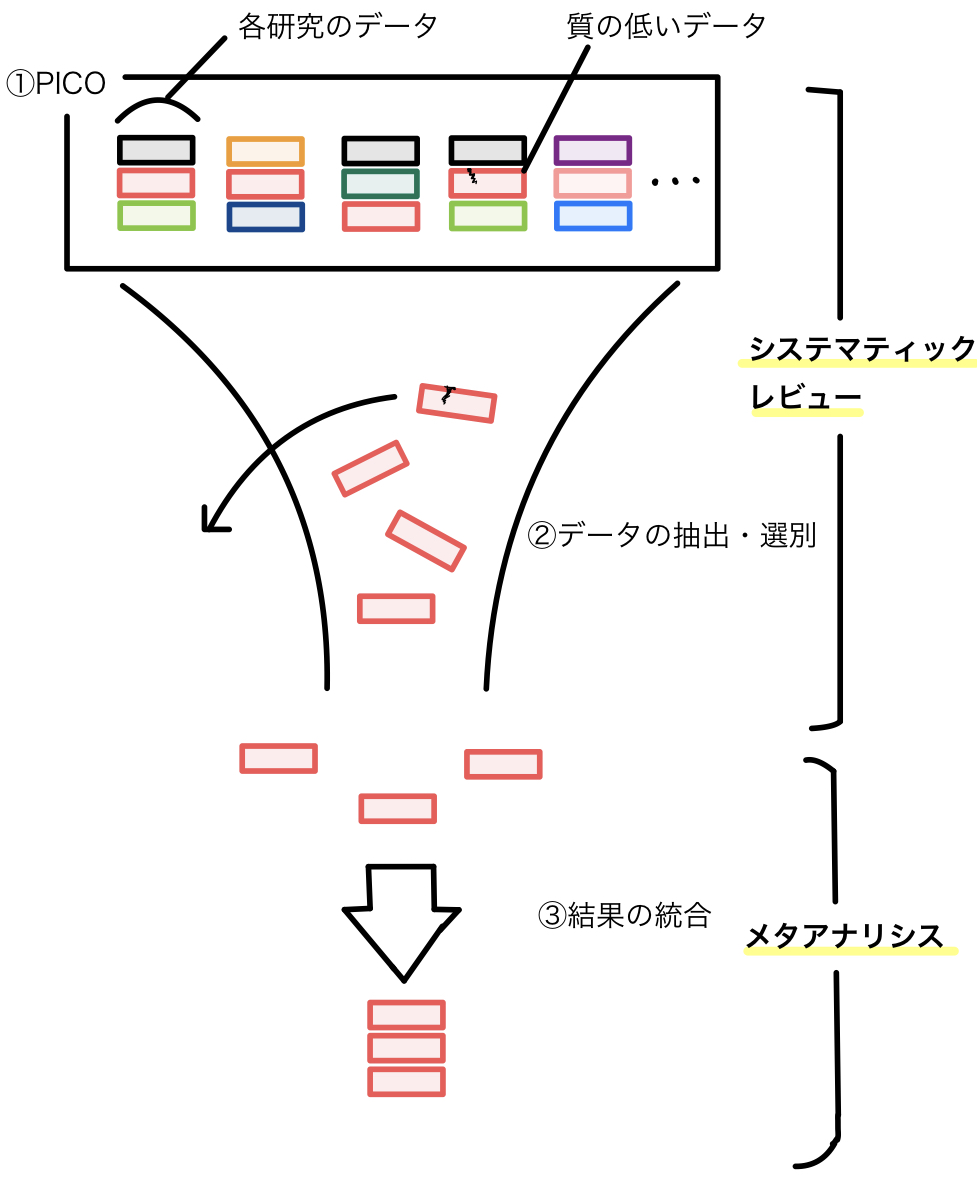
図でまとめてみる
システマティックレビューからメタアナリシスまでの流れをごく簡単に示してみると、以下のような図になります。

順番に見ていきます。
①PICOに沿って集める
まず臨床的疑問をPICO(あるいはPECO、後述します)などの形式にし、同じ臨床的疑問に答える研究を網羅的に集めます。
この時点では質の低いデータや条件が異なるものなども混じっているかもしれません。
②データの抽出・選別
次にデータの抽出・選別をします。前述したように、これは好きに選ぶのではなく、予め方法をよく決めた上で、それに沿って選別します。
細かい点は今後の記事で説明しますが、質の低いデータを除いたり、試験の条件が大きく異なるものを除いたりしていきます。また各研究について”risk of bias”というバイアスの程度を評価していきます。
ここまでがシステマティックレビューで行われることです。
③結果の統合
集められた文献のデータを統合し、結果となる数値を出します。
これによって、ひとつの統一された値を推定することができ、治療などによる効果を具体的に割り出します。
またサブグループ解析として集められた文献の一部に絞って結果を出したり、感度分析として解析方法を変える、質の高いデータに絞る、などして結果の妥当性を検討します。
さらに可能であればNNT(number needed to treat; 何人に治療をしたら1人分のアウトカムが得られるか)、あるいはNNH(number needed to harm; 何人に治療をしたら1人分の害が出るか)を算出する場合もあります。
加えて、研究ごとの結果の違いについて説明可能な要因を見つけ、検討を行います。
この一連の流れに沿って行われる分析がSystematic review and meta-analysisと呼ばれるものです。
システマティックレビューがきちんとしていない場合
では、このシステマティックレビューがない、あるいはきちんとされていないとどうなるでしょうか。図で示すとこのようなものになる可能性があります。

データの抽出・選別の過程が恣意的な偏ったものだと、結果としては全く違ったものになります。
ここで質の低いデータが混ざれば、統合した際に結果の数値が誤った方向に寄ってしまう可能性が高くなります。質の低いデータとは観察研究や盲検化されていないランダム化比較試験など、バイアスが大きくなりやすいデータを指します。こうしたデータの質をよく考慮して統合する必要が出てきます。
また、試験の条件の違うデータをまとめてしまうと、実際は存在しない数値が生み出されるだけになってしまいます。例えば「対象となる年齢が20-40歳の研究」と「対象となる年齢が60−80歳の研究」をまとめるとどうなるでしょうか。それぞれの結果は対象者が全く違うため、まとめた結果の数値はただの架空の数値となってしまい、現実に応用はできません。
つまり、過去の研究を統合すればなんでも良いというわけでは決してなく、データの質や同質性をよく考慮してデータの選別・抽出を行い、統合しなければいけないわけです。というわけで、システマティックレビューの過程は大変に重要なものと言えます。
システマティックレビュー&メタアナリシスの問題点
ここまでの特徴を踏まえて、システマティックレビュー&メタアナリシスの問題点について見ていきます。
事後的解析である
システマティックレビュー&メタアナリシスは上の流れで見たようにあくまで過去にあった研究を「事後的」に抽出し、解析する手法です。
この「事後的」ということがどういう意味を持つかと言えば、恣意的に結果をいくらでもねじ曲げられるということですし、恣意的でなくても結果がねじ曲がることも起き得ます。特に抽出する方法にバイアスがあると容易に間違った結果が導き出されます。
各研究データの質に依存する
仮にこの抽出の方法が問題なかったとしても、そもそも元となる各研究データの質が低い、あるいは規模が小さければ、やはり間違った結果となってしまう可能性は十分にあります。
実際に、小規模な研究を集めたシステマティックレビュー&メタアナリシスが、のちに行われた大規模ランダム化比較試験によって結果を否定される例は散見されます。
参考文献に挙げた『臨床研究を正しく評価するには』において、頭部外傷におけるコルチコステロイドの静注の効果をみたCRASH trialやICUの重症患者におけるアルブミン投与の試験などが挙げられています。参考のためリンクも貼っておきます。
Corticosteroids in acute traumatic brain injury: systematic review of randomised controlled trials
こちらのメタアナリシスでは約2000名の頭部外傷患者が対象となっており、コルチコステロイドは有効という結果が出ていました。
それに対して約10000名を集めたランダム化比較試験では結果はひっくり返り、コルチコステロイド群での死亡率の高さゆえ、試験が中止される結果となりました。
また最近自分が実際に抄読会で遭遇した例として、消化管出血に対するトラネキサム酸の投与の試験があります。
Tranexamic acid for upper gastrointestinal bleedinghtt
2014年のコクランによるシステマティックレビュー&メタアナリシスでは約1600名の患者が対象とされ、有効性が示されました。
これに対して約12000名の大規模ランダム化比較試験では有効性が示されませんでした。もちろん有意差が出なかっただけなので「有効性が示されない=有効性はない」ではないのですが、ここまでの大規模で検出力も高いことを考えると少なくとも臨床的に大きな効果はないだろう、と推定されます。
規模の小さい試験ではどうしても結果の数値のばらつきが大きくなるため、メタアナリシスでそれらを統合したとしても、正しい結果が出るとは限りません。
メタアナリシスはエビデンスの頂点?
こうした誤りが起こりうる点を考えると、以前よく見られたエビデンスピラミッドという図はよくない印象を与えるものだと思ってます。

図:“メタアナリシスがエビデンスの頂点!“というやつです
適切な手法で行われていないシステマティックレビューやメタアナリシスはいくらでも間違った方向に導けますし、各研究データの質が低くても結果が誤る可能性はあるので、「メタアナリシス=エビデンスレベルが高い」という単純な式は全く正しくありません。こうしたイメージがメタアナリシスの盲信を生んでしまうのではないでしょうか。
実際医学に限らず、教育・心理学・脳科学関連の本でも何かと「これはメタアナリシスなので確実性が高い」かのように書かれているのを見ますが、一般向けに分かりやすくそう書いているとしても、中身を見ると実はお粗末なメタアナリシスということがままあります。
メタアナリシスの中でも、抽出する方法にどう問題があるといけないのか、臨床に適用する上での注意点を中心に今後の記事で述べていきたいと思います。
まとめ
・システマティックレビューは同質で質の良い研究データを抽出する
・メタアナリシスは結果を統合する
・適切なシステマティックレビューがないとバイアスが生じ得る
・メタアナリシスの質はデータの抽出過程と元の研究の質次第
続いてはBackgroundから注意点を挙げつつ順番に読み進めていきます。
なお、次回からはより分かり易いことと必要性の高さから「治療」におけるシステマティックレビュー&メタアナリシスを中心に述べていきます。また、メタアナリシスはランダム化比較試験の集合体であることが多いため、ランダム化比較試験(RCT)の質の評価についてある程度わかっていないと、批判的吟味もしづらいように思います。事前にそれがわかった上で読んだ方が分かりやすい内容になるかもしれません。
次回の記事はこちら
実臨床に役立てるメタアナリシスの読み方② -Background編〜Methods編前半











コメントを残す